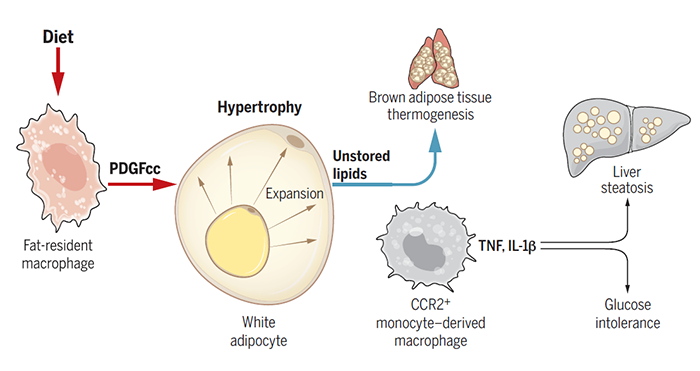
脂肪组织是人体非常重要的代谢器官,它最重要的生理功能是将多余的能量以脂滴的形式储存起来。除了脂肪细胞之外,脂肪组织中还包含一定数量的免疫细胞。大量的研究结果显示,脂肪组织中的巨噬细胞可以直接或者间接的参与机体的能量储存。比如说,骨髓来源的单核巨噬细胞 (也被称作招募型巨噬细胞) 会在趋化因子和炎症信号的刺激下通过膜受体CCR2被招募到脂肪组织中,并通过分泌TNF等炎症因子来调节脂肪组织的功能【1】。有趣的是,抑制CCR2尽管能在一定程度上改善肥胖所引起的并发症 (例如炎症反应、胰岛素抵抗以及脂肪肝的进程),却不能阻止脂肪细胞体积的增大以及体重的增加【2】。但是,靶向CSF1R (巨噬细胞表达的一种生存所必需的受体) 去抑制全部巨噬细胞 (包括招募型巨噬细胞和脂肪组织驻留型巨噬细胞) 的活性则可以减少脂肪的累积,减轻体重【3】。因此,种种线索提示脂肪组织驻留型巨噬细胞可能在脂肪的储存过程中发挥重要功能,然而,究竟是其中哪一类巨噬细胞并通过何种方式来调控脂肪的存储,这两个重要的科学问题却仍未得到回答。2021年7月1日,来自斯隆-凯特琳癌症中心的Frederic Geissmann研究团队在Science上以长文的形式发表了题为Diet-regulated production of PDGFcc by macrophages controls energy storage的研究文章,揭示脂肪组织驻留的巨噬细胞会响应食物中脂肪的摄入并通过旁分泌的形式来调控脂肪的储存。首先,借助不同的转基因动物模型 (小鼠和果蝇),作者确定巨噬细胞的确参与了高脂饮食介导的脂滴储存和脂肪细胞的生长,但是这一过程并不依赖表达CCR2受体的招募型巨噬细胞。由于巨噬细胞会通过分泌细胞因子来调控脂肪组织的功能,作者以果蝇幼虫作为模式生物并利用RNAi筛选的方式,找到了可能由巨噬细胞分泌的参与调控脂滴存储的细胞因子——pvf3 (PDGF/VEGF家族在果蝇中的同源蛋白)。他们发现,敲低pvf3以及它在果蝇中的受体pvr会大幅降低果蝇幼虫中甘油三脂的水平以及脂肪细胞的尺寸,而在小鼠体内则主要是由PDGF/VEGF家族的PDGFc蛋白来行使这一功能。这一结论在Pdgfc敲除小鼠模型以及anti-PDGFcc(PDGFc会形成二聚化的配体)抗体处理下得到验证。因此,这些实验结果表明巨噬细胞是通过分泌PDGFcc来控制脂滴的储存和脂肪组织的大小。进一步,通过细胞分选和RNA测序,作者发现白色脂肪组织驻留的TIM4+F4/80+巨噬细胞是PDGFcc的主要来源。那么PDGFcc又是如何来减少脂肪的累积呢?作者发现,anti-PDGFcc抗体处理并不会改变小鼠能量的摄入、吸收和排出,但是棕色脂肪组织产热相关基因表达与对照组相比却出现了明显的上调。此外,实验组小鼠的体温和氧消耗量也要高于对照组小鼠。这说明PDGFcc会限制棕色脂肪组织的能量消耗进而增加脂肪的储存。为了进一步找到PDGFcc调控脂肪存储的具体分子机制,作者对anti-PDGFcc抗体处理组小鼠与对照组小鼠的腹股沟脂肪组织(iWAT)进行了转录组测序,他们发现一些与脂肪合成以及存储相关的基因表达量发生了显著改变,尤其是负调控脂滴合成以及存储的基因在实验组出现显著上调,例如insig1,ppara,idh2。这说明PDGFcc信号通路会通过上调相关基因的表达来增加白色脂肪组织中脂肪的合成与储存。综上,该研究团队的工作揭示了脂肪组织驻留的巨噬细胞是导致肥胖的“元凶”。简而言之,这类巨噬细胞会通过两种方式来促进脂滴的储存和脂肪细胞的过度生长:一方面,它们通过分泌PDGFcc促进WAT中脂滴的合成与储存;另一方面,这些WAT驻留的巨噬细胞还会抑制BAT的产热,进而减少能量的消耗并促进脂肪的累积。值得一提的是, Science杂志还邀请了牛津大学生理学、解剖学以及遗传学系Conan J. O. O’Brien 和 Ana Domingos教授在同期Science上发表了题为An anti-obesity immunotherapy? 的评论文章。总的来说,O. O’Brien 和 Ana Domingos教授对于这项工作给予了很大的肯定。正如他们在评述中提到,在此之前,大家普遍认为巨噬细胞只是参与了肥胖引起的系统性的炎症反应和代谢紊乱,但是这项研究却发现脂肪组织驻留的巨噬细胞是导致肥胖发生的原因。可以说,这是一个概念上的创新。与此同时,他们也认为在这项工作中仍然存在一些重要的科学问题未得到回答。其中最大的问题就是这一发现在人的身上是否也存在?另外,脂肪组织驻留的巨噬细胞又是如何感知机体的营养状态?相信后续的研究会对这些一一作出解答。https://doi.org/10.1126/science.abe9383
参考文献:
1. G. S. Hotamisligil, P. Arner, J. F. Caro, R. L. Atkinson, B. M. Spiegelman, Increased adipose tissue expression oftumor necrosis factor-alpha in human obesity and insulinresistance. J. Clin. Invest. 95, 2409–2415 (1995).2. T. Satoh et al., Critical role of Trib1 in differentiation of tissue resident M2-like macrophages. Nature 495, 524–528 (2013).3. M. Valdearcos et al., Microglial Inflammatory Signaling Orchestratesthe Hypothalamic Immune Response to Dietary Excess and Mediates Obesity Susceptibility. Cell Metab. 26, 185–197.e3 (2017)